
Propiedades Quimicas
Solubilidad: El grupo carboxilo –COOH confiere carácter polar a los ácidos y permite la formación de puentes de hidrógeno entre la molécula de ácido carboxílico y la molécula de agua. La presencia de dos átomos de oxígeno en el grupo carboxilo hace posible que dos moléculas de ácido se unan entre sí por puente de hidrógeno doble, formando un dímero cíclico.

Punto de ebullición: Los ácidos carboxílicos presentan puntos de ebullición elevados debido a la presencia de doble puente de hidrógeno.
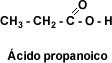
Esto se debe a que el aumento del número de átomos de carbono interfiere en la asociación entre las moléculas. Los ácidos monocarboxílicos aromáticos son sólidos cristalinos con puntos de fusión altos respecto a los ácidos alifáticos.

El comportamiento químico de los ácidos carboxílicos esta determinado por el grupo carboxilo -COOH. Esta función consta de un grupo carbonilo (C=O) y de un hidroxilo (-OH). Donde el -OH es el que sufre casi todas las reacciones: pérdida de protón (H+) o reemplazo del grupo –OH por otro grupo.

Esto hace que los primeros cuatro ácidos monocarboxílicos alifáticos sean líquidos completamente solubles en agua. La solubilidad disminuye a medida que aumenta el número de átomos de carbono. A partir del ácido dodecanóico o ácido láurico los ácidos carboxílicos son sólidos blandos insolubles en agua.

Punto de fusión: El punto de fusión varía según el número de carbonos, siendo más elevado el de los ácidos fórmico y acético, al compararlos con los ácidos propiónico, butírico y valérico de 3, 4 y 5 carbonos, respectivamente. Después de 6 carbonos el punto de fusión se eleva de manera irregular.

Los ácidos fórmico y acético (1, 2 carbonos) son líquidos de olores irritantes. Los ácidos butíricos, valeriano y capróico (4, 5 y 6 carbonos) presentan olores desagradables. Los ácidos con mayor cantidad de carbonos presentan poco olor.



